Vad är ett mRNA-vaccin
mRNA-vaccinet överför RNA till kroppens celler för att uttrycka och producera proteinantigener efter relevanta modifieringar in vitro, vilket leder till att kroppen producerar ett immunsvar mot antigenet och därigenom utökar kroppens immunförsvar.[1,3].
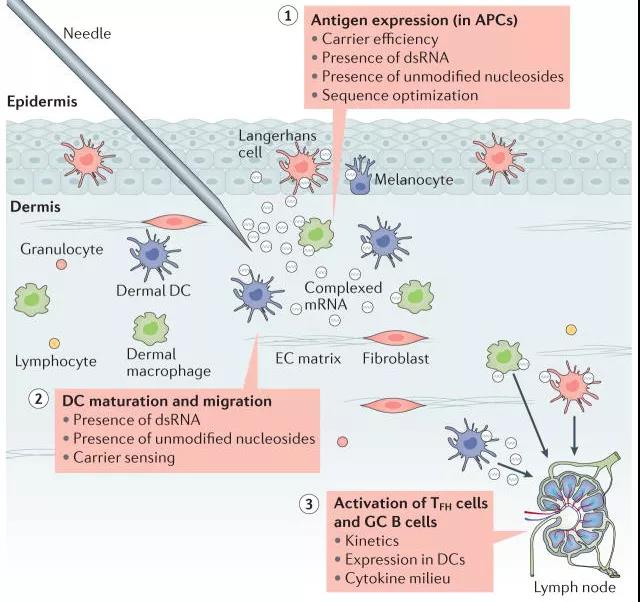
Figur 1: Schematiskt diagram över effekten av direktinjektion av mRNA-vaccin [2]
Klassificering av mRNA-vacciner
mRNA-vacciner delas in i två typer:icke-replikerandemRNA ochsjälvförstärkandemRNA: självförstärkande mRNA kodar inte bara för målantigenet, utan kodar också för replikationen som möjliggör intracellulär RNA-amplifiering och proteinuttrycksmekanism.Icke-replikerande mRNA-vaccin kodar endast för målantigener och innehåller 5'- och 3'-otranslaterade regioner (UTR).De tillhandahåller omfattande stimulering av anpassningsförmåga och medfödd immunitet, nämligen in situ antigenuttryck och farosignalöverföring, och har följande applikationer Funktioner[2,3]
●Kan ge omfattande stimulering av anpassningsförmåga och medfödd immunitet, nämligen in situ antigenuttryck och farosignalöverföring
●Kan inducera ett "balanserat" immunsvar, inklusive humorala och cellulära effektorer och immunminne
●Kan kombinera olika antigener utan att öka komplexiteten i vaccinformuleringen
●Kontinuerlig förbättring av immunförsvaret kan uppnås genom upprepad vaccination, och det finns inget eller lite immunsvar mot bäraren
●Värmestabila mRNA-vacciner kan förenkla transport och förvaring av vacciner
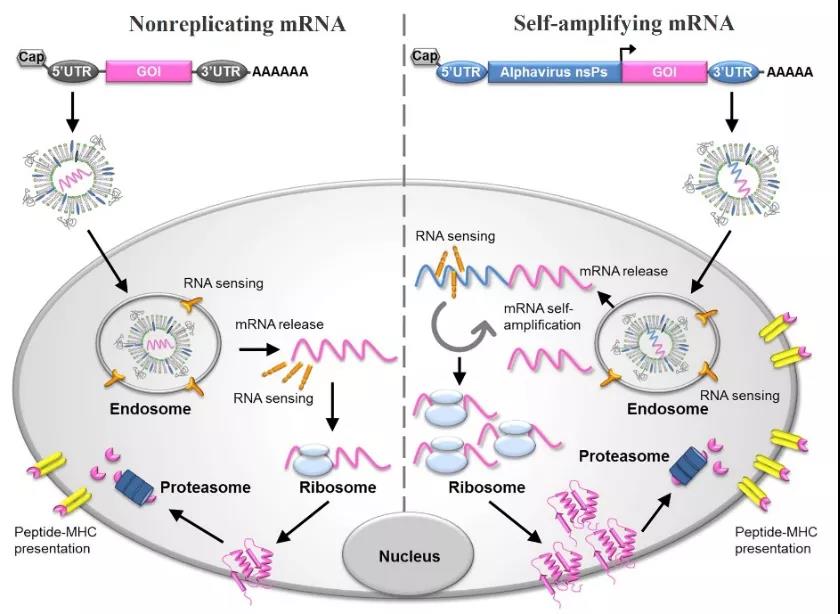
Figur 2: Schematiskt diagram av mRNA-vaccin och dess antigenuttrycksmekanism [4]
Funktioner hos mRNA-vacciner
Jämfört med traditionella vacciner har mRNA-vacciner enkla produktionsprocesser, snabba utvecklingshastigheter, inget behov av cellodling och låg kostnad.Jämfört med DNA-vacciner behöver inte mRNA-vacciner komma in i kärnan och det finns ingen risk för integrering i värdgenomet.Halveringstiden kan justeras genom modifiering.
Tabell 1: För- och nackdelar med mRNA-vacciner
|
| Fördel | Brist |
| mRNA-vaccin | Snabb forskning och utveckling, vaccinproduktion tar bara 40 dagar | Utlösa ett onödigt immunsvar
|
| mRNA-instabilitet under fysiologiska förhållanden, lätt att bryta ned | Kommer inte att integreras i genomet för att undvika möjliga terapeutiska mutationer
| |
| Inget behov av någon nukleär lokaliseringssignal, transkription | Säkerhetskärnkraftens effektivitet återstår att verifiera
|
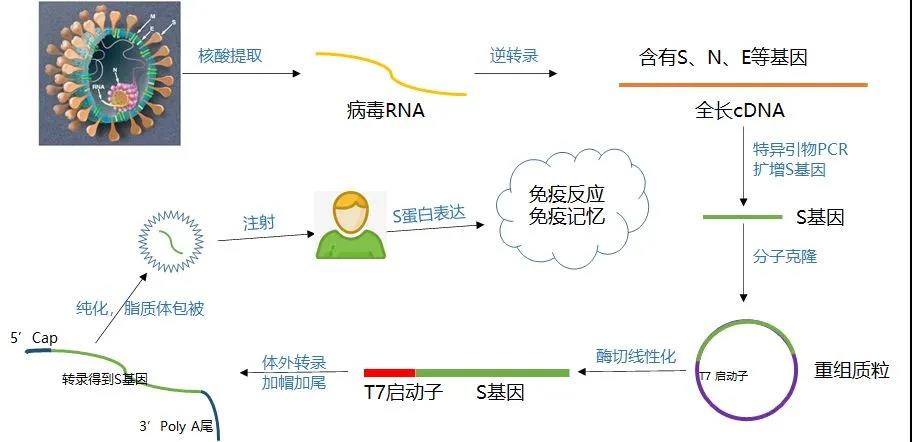
Figur 3: Flödesschema över produktion och beredning av mRNA-vaccin [4]
Foregene Viral RNA-isoleringskit
RT-qPCR enkelt (ett steg)
Förbättrade strategier för framställning av mRNA-vacciner
På grund av den dåliga stabiliteten hos mRNA i sig, enkel nedbrytning av nukleaser i vävnader, låg cellinträdeseffektivitet och låg translationseffektivitet begränsar dessa defekter användningen av mRNA-vacciner.Översättningseffektivitet spelar också en mycket avgörande roll.Leveransvehiklar kan delas in i virala vektorer och icke-virala vektorer (inklusive liposomer, icke-liposomer, virus, nanopartiklar, etc.).Därför behövs relevanta förbättringsåtgärder.Följande är en farmakologisk förbättringsstrategi för mRNA-beredning[2]
1 Syntetisera cap-analoger eller använd capping-enzymer för att stabilisera mRNA och öka proteintranslationen genom att binda till eukaryot translationsinitieringsfaktor 4E (EIF4E)
2 Justera elementen i den 5′-otranslaterade regionen (UTR) och 3′-UTR för att stabilisera mRNA och öka proteintranslationen
3 Att lägga till Poly(A)-svans kan stabilisera mRNA och öka proteintranslationen
4 Modifierade nukleosider för att minska medfödd immunaktivering och öka translation
5 Behandling med RNase III och snabb proteinvätskekromatografi (FPLC) rening kan minska immunaktivering och öka translation
6 Optimera sekvenser eller kodoner för att öka translation
7 Samleverans av translationsinitieringsfaktorer och andra metoder för att förändra translation och immunogenicitet
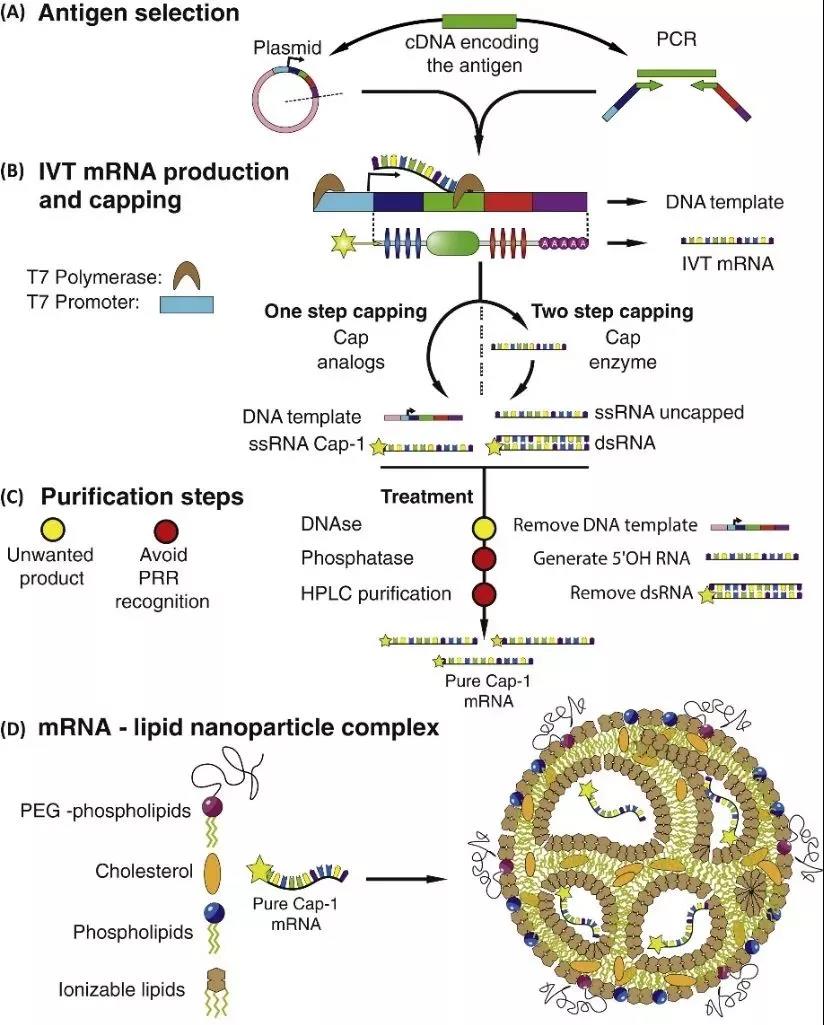
Figur 4: In vitro transkription (IVT) mRNA-produktion och monteringsprocess [5]
Storskalig framställning av plasmid-DNA
Plasmid-DNA-rening tar huvudsakligen bort föroreningar såsom RNA, öppen-cirkel-DNA-endotoxin, värdprotein och värdnukleinsyra, och omvandlar vanligtvis rekombinant plasmid till E. coli.E. coli genomgår högdensitetsjäsning, sedan fast-vätskeseparation och uppsamling av E. coli.E. coli utsätts sedan för alkalisk lysering, centrifugal fast-vätskeseparation och mikrofiltreringsklarning efter lysering, ultrafiltrering och koncentrering efter klarning, och sedan kromatografisk rening.

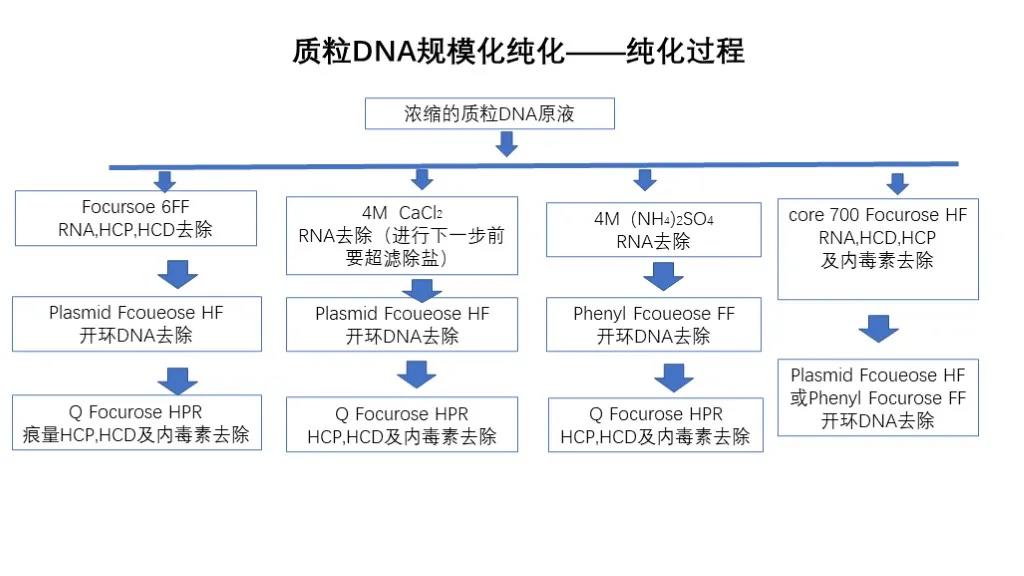
Rening av plasmid-DNA:
Foregene General Plasmid Mini Kit
【1】苗鹤凡, 郭勇, 江新香.mRNA疫苗研究进展及挑战[J].免疫学杂志, 2016(05):446-449.
【2】Pardi N, Hogan MJ, Porter FW, et al.mRNA-vacciner — en ny era inom vaccinologi[J].Nature Reviews Drug Discovery, 2018.
【3】Kramps T., Elbers K. (2017) Introduktion till RNA-vacciner.I: Kramps T., Elbers K. (red) RNA Vaccines.Methods in Molecular Biology, vol 1499. Humana Press, New York, NY.
【4】Maruggi G, Zhang C, Li J, et al.mRNA som en transformativ teknik för vaccinutveckling för att kontrollera infektionssjukdomar[J].Molekylär terapi, 2019.
【5】Sergio Linares-Fernández, Céline Lacroix, , Skräddarsy mRNA-vaccin för att balansera medfödd/adaptiv immunrespons, Trender inom molekylär medicin, volym 26, nummer 3,2020, sidorna 311-323.
Posttid: 2021-05-05








