PCR (polymeraskedjereaktion) är en av in vitro DNA-amplifieringsteknologierna, med en historia på mer än 30 år.
PCR-teknologin var pionjär av Kary Mullis från Cetus, USA 1983. Mullis ansökte om ett PCR-patent 1985 och publicerade den första akademiska PCR-artikeln om vetenskap samma år.Mullis tilldelades Nobelpriset i kemi 1993 för sitt arbete.
Grundläggande principer för PCR
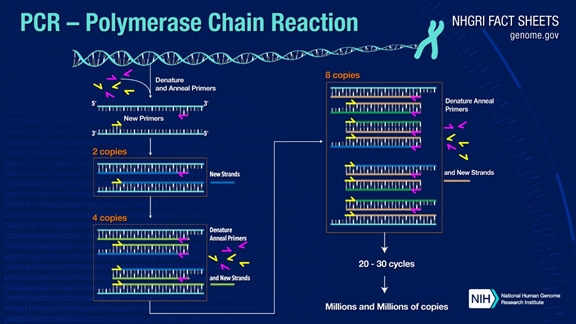
PCR kan amplifiera mål-DNA-fragment med mer än en miljon gånger.Principen är under katalys av DNA-polymeras, med användning av modersträngs-DNA som mall och specifik primer som utgångspunkt för förlängning.Det replikeras in vitro genom steg som denaturering, hybridisering och förlängning.Processen med dottersträngs-DNA som är komplementär till modersträngens mall-DNA.
Standard PCR-processen är uppdelad i tre steg:
1.Denaturering: Använd hög temperatur för att separera DNA-dubbelsträngar.Vätebindningen mellan DNA-dubbelsträngar bryts vid hög temperatur (93-98 ℃).
2.Annealing: Efter att det dubbelsträngade DNA:t har separerats, sänk temperaturen så att primern kan binda till det enkelsträngade DNA:t.
3. Förlängning: DNA-polymeraset börjar syntetisera komplementära strängar längs DNA-strängarna från primrarna bundna när temperaturen sänks.När förlängningen är klar fullbordas en cykel och antalet DNA-fragment fördubblas
Genom att upprepa dessa tre steg 25-35 gånger kommer antalet DNA-fragment att öka exponentiellt.
Det uppfinningsrika med PCR är att olika primrar kan designas för olika målgener, så att målgenfragment kan amplifieras på kort tid.
Hittills kan PCR delas in i tre kategorier, nämligen vanlig PCR, fluorescerande kvantitativ PCR och digital PCR.
Den första generationen av vanlig PCR
Använd ett vanligt PCR-amplifieringsinstrument för att amplifiera målgenen och använd sedan agarosgelelektrofores för att detektera produkten, endast kvalitativ analys kan göras.
De största nackdelarna med den första generationens PCR:
1. Benägen till ospecifik amplifiering och falskt positiva resultat.
2. Detekteringen tar lång tid och operationen är besvärlig.
3. Endast kvalitativa tester kan göras
Andra generationens realtids-PCR
Realtids-PCR, även känd som qPCR, använder fluorescerande prober som kan indikera reaktionssystemets förlopp, och övervakar ackumuleringen av amplifierade produkter genom ackumulering av fluorescerande signaler, och bedömer resultaten genom fluorescenskurvan.Det kan kvantifieras med hjälp av Cq-värde och standardkurva.
Eftersom qPCR-tekniken utförs i ett slutet system, minskar sannolikheten för kontaminering och fluorescenssignalen kan övervakas för kvantitativ detektion, så det är den mest använda i klinisk praxis och har blivit den dominerande tekniken inom PCR.
De fluorescerande substanserna som används i realtidsfluorescerande kvantitativ PCR kan delas in i: TaqMan fluorescerande sond, molekylära beacons och fluorescerande färgämne.
1) TaqMan fluorescerande sond:
Under PCR-amplifiering tillsätts en specifik fluorescerande sond samtidigt som ett par primer tillsätts.Sonden är en oligonukleotid och båda ändarna är märkta med en reporterfluorescerande grupp och en quencher-fluorescerande grupp.
När sonden är intakt absorberas den fluorescerande signalen som emitteras av reportergruppen av den släckande gruppen;under PCR-amplifiering klyver 5'-3' exonukleasaktiviteten hos Taq-enzymet och bryter ner sonden, vilket gör reportern fluorescerande grupp och quencher. Den fluorescerande gruppen separeras, så att fluorescensövervakningssystemet kan ta emot fluorescenssignalen, det vill säga varje gång en DNA-sträng ackumuleras, fluorescerar molekylen och fluorescerar förstärks, cence-signalen är fullständigt synkroniserad med bildningen av PCR-produkten.
2) SYBR fluorescerande färgämne:
I PCR-reaktionssystemet tillsätts ett överskott av SYBR-fluorescerande färgämne.Efter att SYBR-fluorescerande färgämnet är ospecifikt införlivat i DNA-dubbelsträngen avger det en fluorescerande signal.SYBR-färgämnesmolekylen som inte är inkorporerad i kedjan kommer inte att avge någon fluorescerande signal, vilket säkerställer den fluorescerande signalen. Ökningen av PCR-produkter är helt synkroniserad med ökningen av PCR-produkter.SYBR binder endast till dubbelsträngat DNA, så smältkurvan kan användas för att avgöra om PCR-reaktionen är specifik.
3) Molekylär fyr:
Det är en stam-loop dubbelmärkt oligonukleotidsond som bildar en hårnålsstruktur med cirka 8 baser vid 5 och 3 ändarna.Nukleinsyrasekvenserna i båda ändarna är komplementärt parade, vilket gör att den fluorescerande gruppen och den släckande gruppen blir täta.Stäng, ingen fluorescens kommer att produceras.
Efter att PCR-produkten har genererats, under hybridiseringsprocessen, paras den mellersta delen av den molekylära beaconen med en specifik DNA-sekvens, och den fluorescerande genen separeras från quenchergenen för att producera fluorescens.
De största nackdelarna med andra generationens PCR:
Känsligheten saknas fortfarande, och detektionen av lågkopierade prover är felaktig.
Det finns påverkan av bakgrundsvärdet, och resultatet är känsligt för störningar.
När det finns PCR-hämmare i reaktionssystemet är detektionsresultaten känsliga för interferens.
Tredje generationens digitala PCR
Digital PCR (DigitalPCR, dPCR, Dig-PCR) beräknar kopietalet för målsekvensen genom slutpunktsdetektion och kan utföra exakt absolut kvantitativ detektion utan att använda interna kontroller och standardkurvor.
Digital PCR använder slutpunktsdetektion och är inte beroende av Ct-värdet (cykeltröskel), så den digitala PCR-reaktionen påverkas mindre av amplifieringseffektiviteten, och toleransen mot PCR-reaktionshämmare förbättras, med hög noggrannhet och reproducerbarhet.
På grund av egenskaperna för hög känslighet och hög noggrannhet störs den inte lätt av PCR-reaktionshämmare, och den kan uppnå verklig absolut kvantifiering utan standardprodukter, vilket har blivit en forsknings- och tillämpningshotspot.
Beroende på reaktionsenhetens olika former kan den delas in i tre huvudtyper: mikrofluidiska, chip- och droppsystem.
1) Mikrofluidisk digital PCR, mdPCR:
Baserat på mikrofluidteknologin separeras DNA-mallen.Den mikrofluidiska teknologin kan realisera provet nano-uppgradering eller generering av mindre droppar, men dropparna behöver en speciell adsorptionsmetod och sedan kombineras med PCR-reaktionssystemet.mdPCR har gradvis antagits av andra metoder ersätta.
2) Droplet-baserad digital PCR, ddPCR:
Använd teknik för generering av vatten-i-olja droppar för att bearbeta provet till droppar och dela upp reaktionssystemet som innehåller nukleinsyramolekyler i tusentals droppar i nanoskala, som var och en inte innehåller den nukleinsyramålmolekyl som ska detekteras, eller innehåller en till flera nukleinsyramålmolekyler som ska testas.
3) Chipbaserad digital PCR, cdPCR:
Använd den integrerade vätskevägsteknologin för att gravera många mikrorör och mikrohåligheter på kiselskivor eller kvartsglas, och kontrollera flödet av lösningen genom olika kontrollventiler, och dela upp provvätskan i nanometer av samma storlek i reaktionsbrunnarna för digital PCR-reaktion för att uppnå absolut kvantifiering.
De största nackdelarna med tredje generationens PCR:
Utrustningen och reagensen är dyra.
Kvalitetskraven på mallen är höga.Om mallens kvantitet överstiger mikrosystemkvantiteten kommer den att vara omöjlig att kvantifiera, och om den är för liten kommer kvantifieringsnoggrannheten att minska.
Falska positiva kan också genereras när det finns ospecifik amplifiering.
Posttid: 30 juli 2021