I qPCR-experiment är primerdesign också en mycket viktig länk.Huruvida primrarna är lämpliga eller inte är nära relaterat till om amplifieringseffektiviteten når standarden, om de amplifierade produkterna är specifika och om de experimentella resultaten är tillgängliga.
Så hur gör man qPCR-primerspecificiteten bättre?Hög förstärkningseffektivitet?
Idag tar vi dig att designa qPCR-primers tillsammans och låter qPCR-primerdesign bli en effektiv kunskap i experiment.
När du designar qPCR-primers, var vanligtvis uppmärksam på följande punkter: primers bör utformas över introner så mycket som möjligt, produktlängden ska vara 100-300 bp, Tm-värdet ska vara så nära 60°C som möjligt och uppströms- och nedströmsprimrarna ska vara så nära som möjligt, och slutet av primern ska vara G C, etc. wait.
1. Design av primers som spänner över introner
När man designar qPCR-primers kan valet av primers designade över introner förhindra att gDNA-mallen amplifieras, och produkterna härrör alla från amplifieringen av cDNA, vilket eliminerar påverkan av gDNA-kontamination.
2. Primerlängd
Primerlängden är i allmänhet mellan 18-30 nt, och längden på amplifieringsprodukten bör kontrolleras mellan 100-300 bp så mycket som möjligt.
Om primern är för kort kommer den att leda till ospecifik amplifiering, och om den är för lång kommer den lätt att bilda sekundär struktur (som hårnålsstruktur).Om amplifieringsprodukten är för lång är den inte lämplig för reaktionen av polymeras, vilket kommer att påverka effektiviteten av PCR-amplifiering.
3. GC-innehåll och Tm-värde
GC-halten i primers bör kontrolleras mellan 40 % och 60 %.Om den är för hög eller för låg är den inte gynnsam för att initiera reaktionen.GC-innehållet i de framåtriktade och omvända primrarna bör vara nära densamma för att erhålla samma Tm-värde och glödgningstemperatur.
Tm-värdet bör vara mellan 55-65°C så långt det är möjligt, vanligtvis runt 60°C, och Tm-värdet för uppströms och nedströms bör vara så nära som möjligt, helst inte mer än 4°C.
4. Undvik att välja A i 3′-änden av primern
När 3′-änden av primern är felaktig, finns det stora skillnader i synteseffektiviteten för olika baser.När den sista basen är A, kan den också initiera kedjesyntes även i fallet med felmatchning, och när den sista basen är T When, reduceras effektiviteten av missmatchningsinduktionen avsevärt.Försök därför att undvika att välja A i 3′-änden av primern, och det är bättre att välja T.
Om det är en sondprimer kan 5′-änden av sonden inte vara G, eftersom även när en enda G-bas är ansluten till FAM-fluorescerande reportergruppen, kan G också släcka den fluorescerande signalen som emitteras av FAM-gruppen, vilket resulterar i falskt negativa resultat.Dyka upp.
5. Basfördelning
Fördelningen av de fyra baserna i primern är företrädesvis slumpmässig, och undviker mer än 3 på varandra följande G eller C vid 3'-änden och mer än 3 på varandra följandeG eller C är lätta att generera parning i den GC-rika sekvensregionen.
6. Primerdesignområdet bör undvika komplexa sekundära strukturer.
Den sekundära strukturen som bildas av den enkla strängen av amplifieringsprodukten kommer att påverka den mjuka utvecklingen av PCR.Genom att förutsäga om det finns en sekundär struktur i målsekvensen i förväg, försök att undvika denna region i utformningen av primrar.
7. Primerna själva och mellan primrarna bör försöka undvika på varandra följande komplementära baser.
Det kan inte finnas någon konsekutiv komplementaritet med fyra baser mellan själva primern och primern.Själva primern bör inte ha en komplementär sekvens, annars kommer den att vika sig själv för att bilda en hårnålsstruktur, vilket kommer att påverka hybridiseringskombinationen av primern och mallen.
Komplementära sekvenser kan inte existera mellan uppströms och nedströms primrar.Komplementaritet mellan primrar kommer att producera primerdimerer, vilket kommer att minska PCR-effektiviteten och till och med påverka kvantitativ noggrannhet.Om primer-dimer- och hårnålsstrukturerna är oundvikliga, bör △G-värdet inte vara för högt (bör vara mindre än 4,5 kcal/mol).
8. Primerna amplifierar den målspecifika produkten.
Det slutliga målet med qPCR-detektion är att förstå mängden av målgenen.Om icke-specifik amplifiering inträffar kommer kvantifieringen att vara felaktig.Därför, efter att primrarna har designats, måste de testas av BLAST, och specificiteten för produkterna jämförs i sekvensdatabasen.
Därefter tar vi den humana GAS6-genen (Growth arrest specific 6) som ett exempel för att designa qPCR-primers.
01 frågegen
Homo GAS6genom NCBI.Här bör vi vara uppmärksamma på att jämföra gennamnet och arterna för att säkerställa att de är konsekventa.
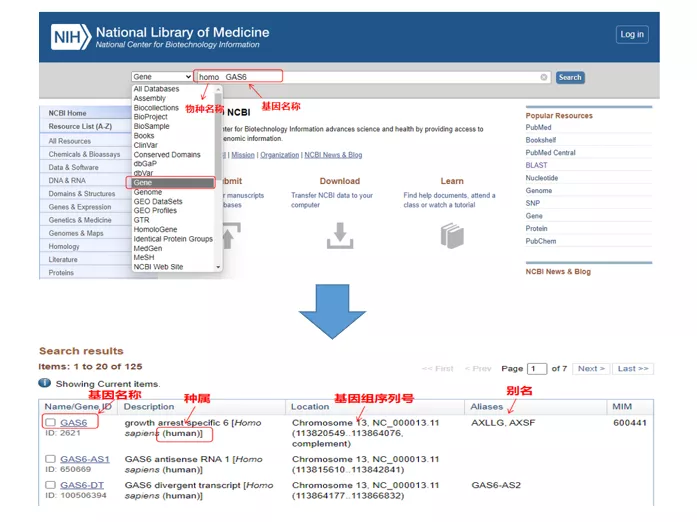 02 Hitta gensekvensen
02 Hitta gensekvensen
(1) Om målsekvensen är genomiskt DNA, välj den första, som är genens genomiska DNA-sekvens.
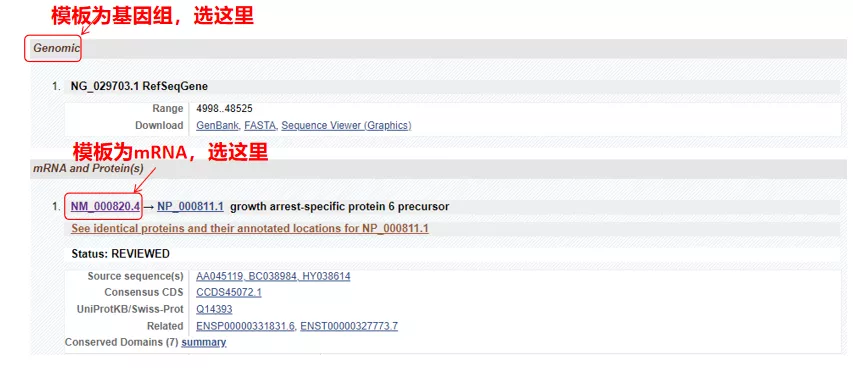 (2) Om målsekvensen är mRNA, välj den andra.Efter att ha angett, klicka på "CDS" i tabellen nedan.Den bruna bakgrundssekvensen är genens kodande sekvens.
(2) Om målsekvensen är mRNA, välj den andra.Efter att ha angett, klicka på "CDS" i tabellen nedan.Den bruna bakgrundssekvensen är genens kodande sekvens.
 03 Design primers
03 Design primers
Gå in i Primer-BLAST-gränssnittet
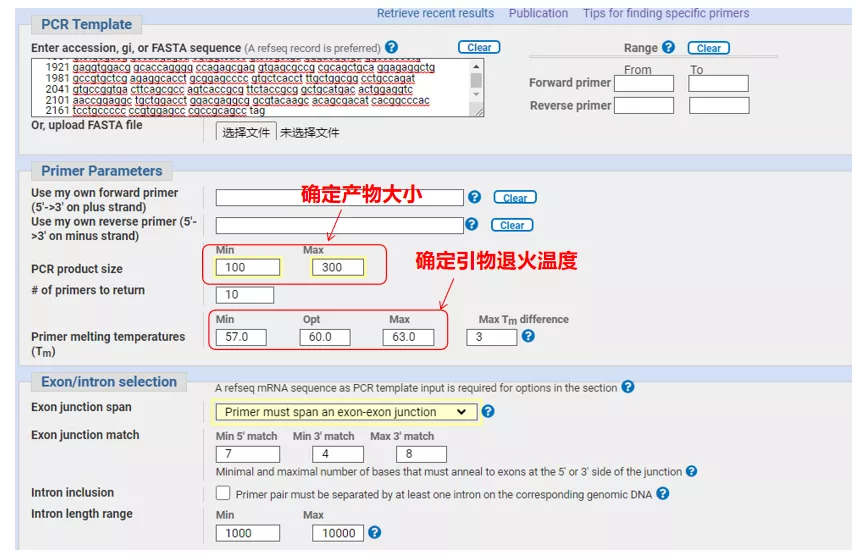
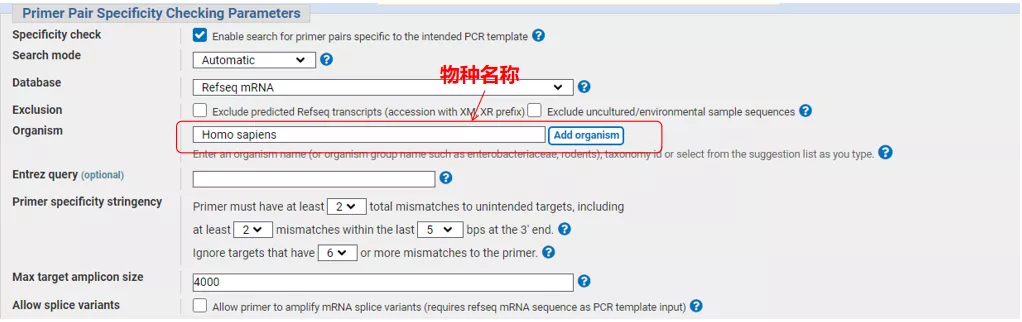
 Ange gensekvensnumret eller sekvensen i Fasta-format uppe till vänster och fyll i relevanta parametrar.
Ange gensekvensnumret eller sekvensen i Fasta-format uppe till vänster och fyll i relevanta parametrar.
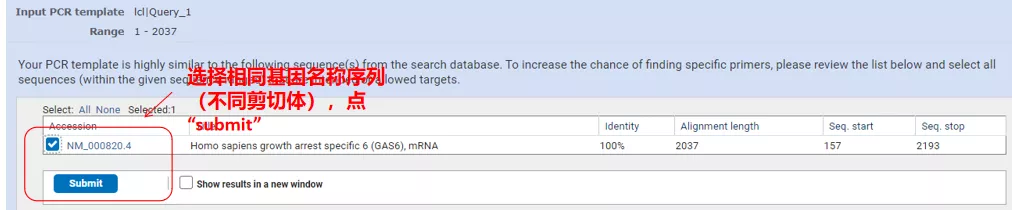
Klicka på "Hämta primers" och NCBI kommer att dyka upp för att berätta att ett sådant parameterval kommer att förstärkas till andra splitsningsvarianter.Vi kan kontrollera de olika skarvningsvarianterna och skicka in dem för att få rätt primerpar (som visas i figuren nedan).Denna process kan ta tiotals sekunder att köra.
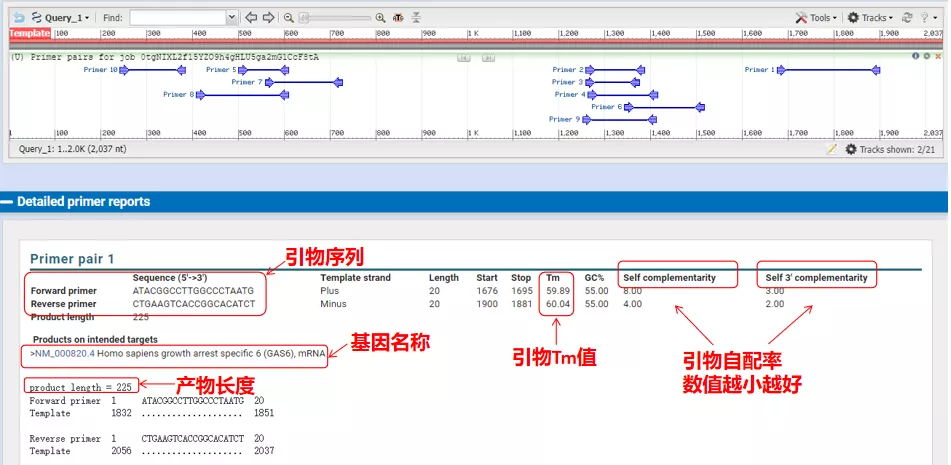 Glödgningstemperaturerna för dessa primerpar är runt 60°C.Välj enligt syftet med experimentet primers med måttlig längd, bra specificitet och mindre självkomplettering av primers för experimentet, och framgångsfrekvensen är ganska hög!
Glödgningstemperaturerna för dessa primerpar är runt 60°C.Välj enligt syftet med experimentet primers med måttlig längd, bra specificitet och mindre självkomplettering av primers för experimentet, och framgångsfrekvensen är ganska hög!
04Verifiering av primerspecificitet
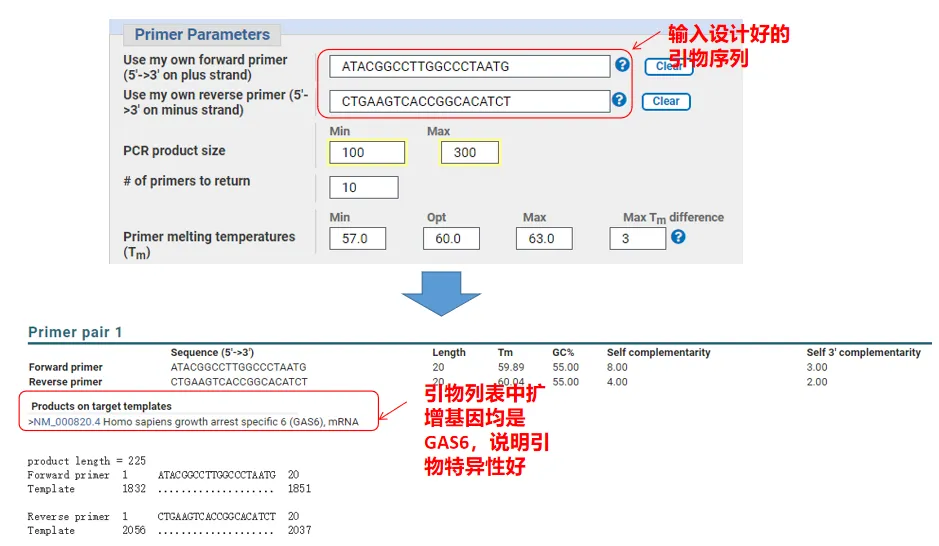
Faktum är att, förutom att designa primers, kan Primer-Blast också utvärdera de primers vi designat själva.Återgå till sidan för primerdesign, ange uppströms- och nedströmsprimrarna vi designade, och andra parametrar kommer inte att justeras.Efter att ha skickat in kan du se om primerparet också finns på andra gener.Om alla visas på genen vi vill amplifiera, vilket indikerar att specificiteten hos detta primerpar är stor!(Till exempel är detta det enda resultatet av primerfrågan!)
05 Primer kvalitetsbedömning
Vilken typ av primer är den "perfekta" primern som kombinerar "amplifieringseffektivitet upp till standard", "förstärkta produktegenskaper" och "tillförlitliga experimentella resultat"?
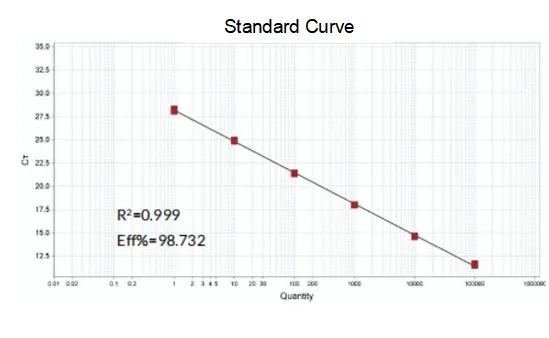 Förstärkningseffektivitet
Förstärkningseffektivitet
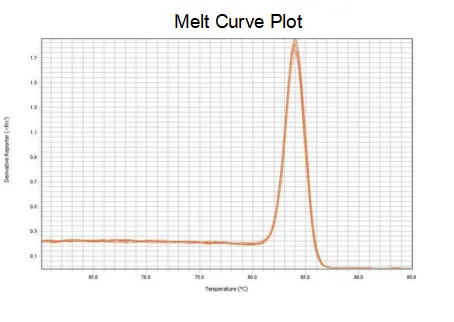 smältkurva
smältkurva
Amplifieringseffektiviteten för primrarna når 90%-110%, vilket betyder att amplifieringseffektiviteten är god, och smältkurvan har en enda topp och vanligtvis Tm>80°C, vilket betyder att amplifieringsspecificiteten är god.
Relaterade produkter:
Realtids PCR Easy–SYBR GREEN I
Realtids PCR Easy-Taqman
Posttid: 2023-02-10








