Realtids PCR Easyᵀᴹ-Taqman
Kitbeskrivningar
2X Real PCR EasyTMMix-Taqman tillhandahålls av Real Time PCR EasyTM-Taqman kit är ett nytt premix-system som använder specifika fluorescerande prober för realtids PCR-amplifieringsreaktioner, vilket avsevärt kan förbättra produktspecificiteten och reaktionskänsligheten.ROX tillhandahålls som intern kontrollfärg.
2X Real PCR EnkelTMMix-Taqman innehåller Foregenes unika hot-start Taq DNA Polymerase.Jämfört med vanliga Taq-enzymer har det fördelarna med hög amplifieringseffektivitet, stark specifik amplifieringsförmåga och låg missmatchningshastighet.Det kan minska ospecifik amplifiering och förbättra noggrannheten i PCR.
Specifikationer
| Realtids PCR enkeltTM-Taqman | ||||
| Kitsammansättning (20μl system) | QP-01021 | QP-01022 | QP-01023 | QP-01024 |
| 200T | 500T | 1000T | 2000T | |
| 2×Verklig PCRLättTMBlanda-Taqman | 1 ml ×2 | 1.7 ml x3 | 1.7 ml x6 | 1.7 ml x12 |
| 20×ROX referensfärgämne | 200 μl | 0,5ml | 1 ml | 1 ml × 2 |
| DNas-fri ddH2O | 1,7 ml | 1.7 ml x2 | 10 ml | 20 ml |
| Ikonstruktion | 1 | 1 | 1 | 1 |
Egenskaper & fördelar
■ Enkel—2X PCR-blandning för att minska experimentella fel och drifttid
■ Specifik – optimerad buffert och hot-start Taq-enzym kan förhindra ospecifik amplifiering och primerdimerbildning
■ Hög känslighet – kan upptäcka låga kopior av mall
■ Bra mångsidighet – kompatibel med de flesta kvantitativa PCR-instrument i realtid
Kitapplikation
qPCR-analys
Arbetsflöde
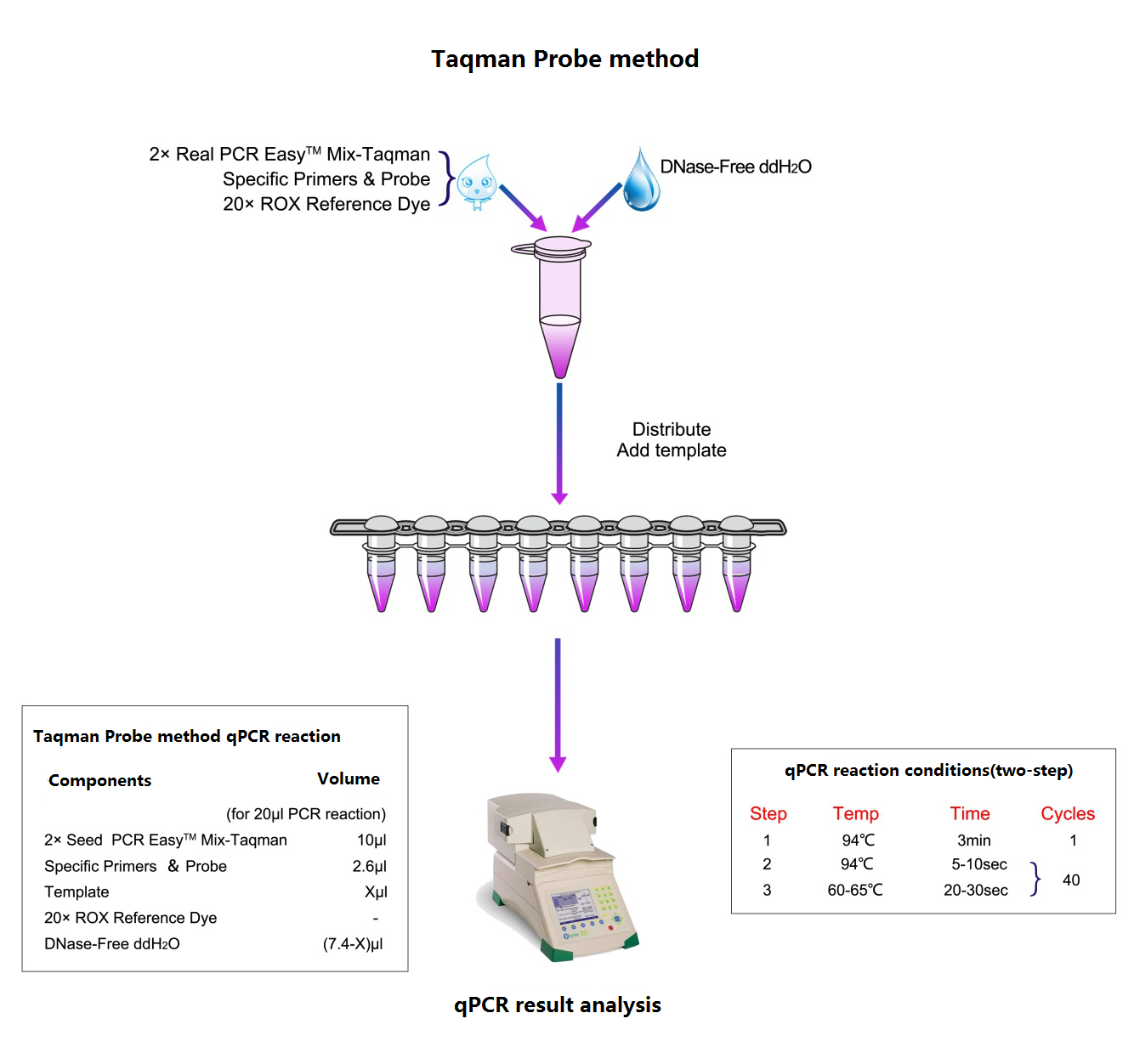
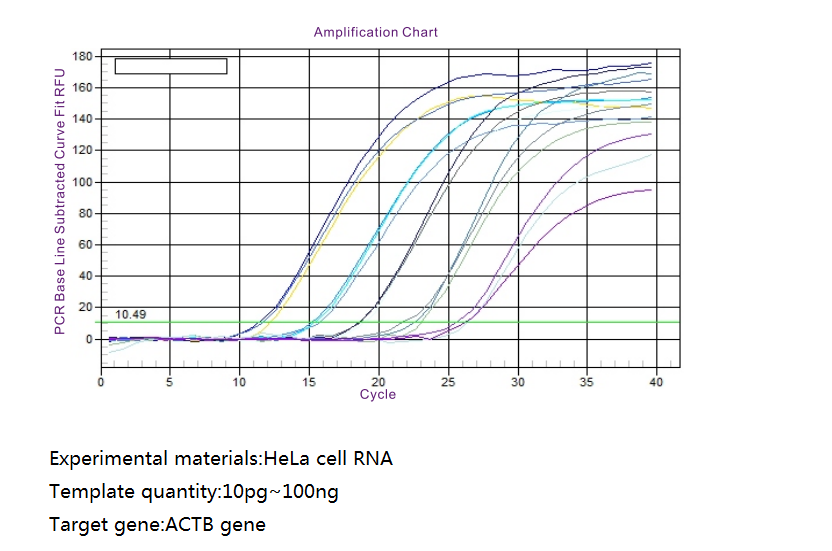
Grafisk
Lagring och hållbarhet
Detta kit bör förvaras borta från ljus och bör förvaras vid -20 ℃.Om den används ofta kan den även förvaras vid 4 ℃ under en kort tid (10 dagar).
Inga förstärkningssignaler
1. Taq DNA-polymeraset i kitet förlorar sin aktivitet på grund av felaktig förvaring eller utgång av kitet.
Rekommendation: Bekräfta förvaringsvillkoren för kitet;tillsätt igen en lämplig mängd Taq DNA-polymeras till PCR-systemet eller köp ett nytt PCR-kit i realtid för relaterade experiment.
2. Det finns många hämmare av Taq DNA-polymeras i DNA-mallen.
Förslag: Rensa mallen igen eller minska mängden mall som används.
3. Mg2+-koncentrationen är inte lämplig.
Rekommendation: Mg2+-koncentrationen av den 2× Real PCR-blandning vi tillhandahåller är 3,5 mM.Men för vissa speciella primers och mallar kan Mg2+-koncentrationen vara högre.Därför kan du direkt lägga till MgCl2 för att optimera Mg2+-koncentrationen.Det rekommenderas att öka Mg2+ 0,5 mM varje gång för optimering.
4. PCR-amplifieringsförhållandena är inte lämpliga och primersekvensen eller koncentrationen är felaktig.
Förslag: bekräfta att primersekvensen är korrekt och att primern inte har brutits ned;Om förstärkningssignalen inte är bra, försök att sänka anlöpningstemperaturen och justera primerkoncentrationen på lämpligt sätt.
5. Mängden mall är för liten eller för mycket.
Rekommendation: Utför malllineariseringsgradientspädning och välj mallkoncentrationen med den bästa PCR-effekten för realtids-PCR-experiment.
NTC har för högt fluorescensvärde
1. Reagenskontamination orsakad under drift.
Rekommendation: Ersätt med nya reagenser för realtids-PCR-experiment.
2. Kontaminering inträffade under beredningen av PCR-reaktionssystemet.
Rekommendation: Vidta nödvändiga skyddsåtgärder under drift, såsom: bära latexhandskar, använda pipettspets med filter, etc.
3. Primerna bryts ned och nedbrytningen av primrarna kommer att orsaka ospecifik amplifiering.
Förslag: Använd SDS-PAGE-elektrofores för att detektera om primrarna är nedbrutna och ersätt dem med nya primers för realtids-PCR-experiment.
Primer-dimer eller icke-specifik amplifiering
1. Mg2+-koncentrationen är inte lämplig.
Rekommendation: Mg2+-koncentrationen av den 2× Real PCR EasyTM Mix vi tillhandahåller är 3,5 mM.Men för vissa speciella primers och mallar kan Mg2+-koncentrationen vara högre.Därför kan du direkt lägga till MgCl2 för att optimera Mg2+-koncentrationen.Det rekommenderas att öka Mg2+ 0,5 mM varje gång för optimering.
2. PCR-glödgningstemperaturen är för låg.
Förslag: Öka PCR-glödgningstemperaturen med 1 ℃ eller 2 ℃ varje gång.
3. PCR-produkten är för lång.
Rekommendation: Längden på realtids-PCR-produkten bör vara mellan 100-150 bp, inte mer än 500 bp.
4. Primerna bryts ned och nedbrytningen av primrarna kommer att leda till uppkomsten av specifik amplifiering.
Förslag: Använd SDS-PAGE-elektrofores för att detektera om primrarna är nedbrutna och ersätt dem med nya primers för realtids-PCR-experiment.
5. PCR-systemet är felaktigt, eller så är systemet för litet.
Förslag: PCR-reaktionssystemet är för litet gör att detektionsnoggrannheten minskar.Det är bäst att använda reaktionssystemet som rekommenderas av det kvantitativa PCR-instrumentet för att köra realtids-PCR-experimentet igen.
Dålig repeterbarhet av kvantitativa värden
1. Instrumentet fungerar inte.
Förslag: Det kan finnas fel mellan varje PCR-hål i instrumentet, vilket resulterar i dålig reproducerbarhet under temperaturhantering eller detektering.Kontrollera enligt instruktionerna för motsvarande instrument.
2. Provets renhet är inte bra.
Rekommendation: Orena prover kommer att leda till dålig reproducerbarhet av experimentet, vilket inkluderar renheten av mallen och primers.Det är bäst att återrena mallen, och primrarna renas bäst med SDS-PAGE.
3. Förberedelse- och lagringstiden för PCR-systemet är för lång.
Förslag: Använd PCR-systemet i realtid för PCR-experiment omedelbart efter beredning, och låt det inte stå åt sidan för länge.
4. PCR-amplifieringsförhållandena är inte lämpliga och primersekvensen eller koncentrationen är felaktig.
Förslag: bekräfta att primersekvensen är korrekt och att primern inte har brutits ned;Om förstärkningssignalen inte är bra, försök att sänka anlöpningstemperaturen och justera primerkoncentrationen på lämpligt sätt.
5. PCR-systemet är felaktigt, eller så är systemet för litet.
Förslag: PCR-reaktionssystemet är för litet gör att detektionsnoggrannheten minskar.Det är bäst att använda reaktionssystemet som rekommenderas av det kvantitativa PCR-instrumentet för att köra realtids-PCR-experimentet igen.